Inseminazione Intrauterina
In breve IUI. È una tecnica semplice con un indice di successo notevole
Secondo la definizione data dall' Organizzazione Mondiale della Sanità (OMS), con il termine "sterilità" s'intende quella condizione in cui una coppia dopo un anno (per alcuni Autori, due) di rapporti sessuali non protetti non riesce ad ottenere una gravidanza,Il termine "infertilità" è riservato, invece, ai casi in cui non si arriva a uno sviluppo fetale da riuscire a fare nascere un feto vivo e vitale.
La specie umana rispetto a quasi tutti gli altri mammiferi è da considerarsi poco fertile. Una coppia giovane, fertile, con regolare attività sessuale non ha più del 20 - 25% di possibilità di concepire per ogni ciclo ovulatorio.A ciò si aggiunge, nelle popolazioni occidentali (Europa e nord America), la consolidata abitudine a posticipare la data
della ricerca della gravidanza, per motivi culturali e di costume (problemi di carriera, lavoro, casa e così via),
che ne abbassa ulteriormente la capacitá riproduttiva.
La fertilità della donna é infatti massima intorno ai 20-25 anni, per poi decrescere gradualmente fino alla menopausa.
Dopo i 36-38 anni la fertilità risulta già sensibilmente ridotta.
Il primo incontro è molto importante poiché viene raccolta tutta la storia clinica e viene indagata l'anamnesi riproduttiva
della coppia che servirà ad orientare l'iter delle indagini diagnostiche da effettuare.
È fondamentale arrivare ad una diagnosi d'infertilità prima di passare ad una eventuale cura medica o alla tecnica terapeutica assistita adeguata.
In caso di necessità o durante una semplice criticità può essere richiesto l’aiuto di uno psicologo.
Dopo la prima consulenza è necessario accertare le cause che hanno determinato l'incapacità riproduttiva.
Gli studi mostrano che le cause femminili rappresentano il 40% dei casi di infertilità, un altro 40% è di
origine maschile e solo circa il 20% resta inspiegato.
Gli esami prescritti durante la prima visita servono ad individuare le cause d’infertilità e definire
il trattamento più efficace per realizzare il progetto di genitorialità.
Tra le cause più frequenti di infertilità femminile si distinguono:
Tra le cause più frequenti di infertilità femminile si distinguono:
* (parametri di normalità secondo l’Organizzazione Mondiale della Sanità, 2021)
Infertilità idiopatica o inspiegataSi intende, con tale termine, tutti quei casi in cui non si riesce ad individuare una causa precisa di infertilità.
Le tecniche di RMA sono distinte in:
Alla paziente vengono somministrati farmaci in varie combinazioni tra loro che stimolano l'ovaio alla crescita multipla di follicoli.
Ciascun follicolo dovrebbe contenere un ovocita.
L'andamento della stimolazione è seguito valutando con dosaggi ormonali, il livello dell'estradiolo nel sangue, l'ormone prodotto dai follicoli in crescita e controllando con le ecografie, la crescita volumetrica dei follicoli e lo sviluppo dell' endometrio.
Esistono diversi protocolli di stimolazione follicolare multipla dell'ovaio; è il medico insieme alla coppia che, di volta in volta, a seconda del caso clinico, sceglie il protocollo più idoneo.
Di seguito sono descritti brevemente i due protocolli più usati nel nostro Centro:
La stimolazione con le gonadotropine è preceduta dalla verifica ecografica ed ormonale dell’avvenuta ovulazione e da una fase di blocco temporaneo del ciclo naturale ottenuto grazie all’utilizzo di un farmaco (agonista del GnRh), somministrato a partire dal 21° giorno del ciclo mestruale precedente alla stimolazione. Quindi, la stimolazione inizia all’incirca da 9 a15 giorni dopo l’inizio della somministrazione dell’agonista ed esattamente dopo aver effettuato un prelievo per il dosaggio dell’estradiolo ed una ecografia per verificare l’avvenuto blocco ipofisario.
Da questo momento la paziente inizia la somministrazione giornaliera di ormoni (gonadotropine) e l’esecuzione di 3 - 4 ecografie a giorni alterni, secondo la risposta ovarica alla stimolazione.
La durata della stimolazione è di circa 12 giorni.
In questo protocollo la stimolazione multipla dei follicoli ovarici, con gonadotropine, comincia direttamente al 2°-3° giorno dopo l’inizio delle mestruazioni (del mese individuato per il tentativo riproduttivo assistito).
La mattina del giorno di inizio della stimolazione viene effettuato un prelievo per il dosaggio dell’estradiolo e del progesterone ed una ecografia trans- vaginale dell’utero e delle ovaie. Da questo momento la donna inizia la somministrazione giornaliera di ormoni (gonadotropine) per via sottocutanea.
Dopo circa 5 giorni di stimolazione si continua il monitoraggio ormonale ed ecografico a giorni alterni con altri 3-4-appuntamenti.
In questo protocollo il farmaco chiamato “Antagonista” si usa generalmente a partire dal 6-8 giorno di stimolazione ovarica, cioè quando il follicolo maggiore raggiunge il diametro di circa 14 mm.
Si basa sul principio di lasciare sviluppare il follicolo, che naturalmente la donna produce, con il corrispettivo ovocita al suo interno. Una volta che il follicolo sviluppato, naturalmente, raggiunge il diametro di 14 millimetri, si somministra sottocute ogni sera una fiala di antagonista, contemporaneamente si comincia la somministrazione di circa 150 unità di gonadotropine fino ad arrivare al diametro follicolare di 17-18 millimetri. A questo stadio si somministrano 5.000 unità di HCG per determinare l’ultima maturazione dell’ovocita e indurre l’ovulazione. A 34-36 ore dalla somministrazione dell’HCG si procede al prelievo ovocitario. Con il protocollo naturale modificato non può essere recuperato più di un ovocita. Il procedimento successivo è uguale alla ICSI.
4. Monitoraggio ecografico e ormonale nei protocolli di stimolazione della crescita follicolare multiplaIn tutti i protocolli di riproduzione medicalmente assistita in vitro, Il monitoraggio ecografico ed ormonale della stimolazione ovarica per la crescita follicolare multipla viene effettuato dagli operatori del nostro Centro, che giornalmente analizzano (daily monitoring), contemporaneamente, i risultati dei prelievi ematici per i dosaggi ormonali (Estradiolo, LH e Progesterone) eseguiti al mattino e i risultati delle ecografie ovariche trans-vaginali, aggiustando, giorno dopo giorno, il dosaggio più adatto per il prosieguo del trattamento di stimolazione ovarica. Questo metodo di monitoraggio permette il controllo, la regolazione e l'eventuale modifica del protocollo farmacologico. L’equipe si preoccuperà di contattare telefonicamente, durante il pomeriggio, la coppia per eventuali variazioni della terapia in corso. Quando i follicoli raggiungono il diametro ottimale di 17-18 mm ed i dosaggi ormonali sono considerati ottimali, si induce farmacologicamente la maturazione ovocitaria tramite la somministrazione dell’HCG (gonadotropina corionica umana).
Si ricorre alla IUI quando esistono lievi alterazioni della qualità dello sperma, problemi ovulatori, alterazioni del muco cervicale o in presenza di deficit sessuali (impotenza). Per poter accedere a questa metodica è necessario che entrambe le tube, o, almeno una, devono essere pervie e soprattutto funzionanti, e, il liquido seminale deve essere normale o solo lievemente insufficiente. La donna viene sottoposta ad una leggera stimolazione ovarica e monitorata, ogni due o tre giorni, con dosaggi ormonali ed ecografie effettuate con la scadenza richiesta dalla risposta ovaricare, il monitoraggio inizia con la stimolazione e si completa alla maturità dei follicoli che si raggiunge quando le loro dimensioni follicolari hanno un diametro medio di 17-18 mm.
A questo punto si induce, farmacologicamente, lo scoppio dei follicoli tramite la somministrazione dell' HCG (gonadotropina corionica umana) e dopo 34-36 ore dall'induzione si effettua l'inseminazione intrauterina. Lo sperma viene prodotto dal partner per masturbazione. In laboratorio vengono selezionati gli spermatozoi migliori (capacitazione), che vengono così depositati da un ginecologo del Centro all'interno della cavità uterina per mezzo di un sottile catetere, con un atto completamente indolore. Fasi dell'inseminazione intrauterina (IUI)
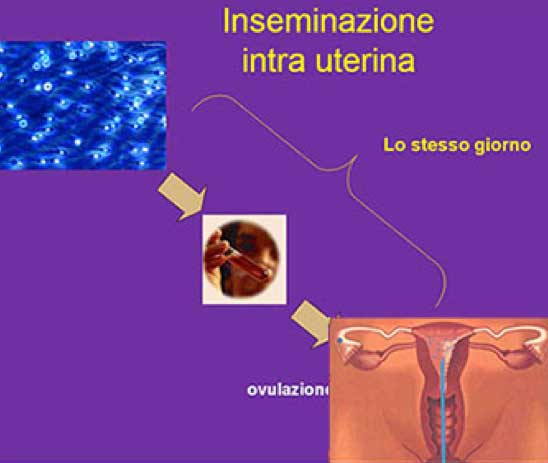
Figura 1: : Inseminazione intrauterina.
1. Trattamento farmacologico per indurre la maturazione di follicolare multipla.
2. Monitoraggio ecografico per valutare la crescita dei follicoli e lo sviluppo dell' endometrio mediante ecografia transvaginale
3. Monitoraggio dell' estradiolo, dell'LH e del progesterone su sangue periferico durante la stimolazione follicolare multipla.
4. Preparazione del liquido seminale e deposizione del seme nella cavità uterina.
5. Supporto farmacologico della fase luteale.
Le tecniche di riproduzione medicalmente assistita (RMA) sono dette ’in vitro’ se le cellule umane sono lavorate in laboratorio, e cioè, fuori dall’organismo vivente. La figura seguente schematizza le tecniche di riproduzione medicalmente assistite in vitro.
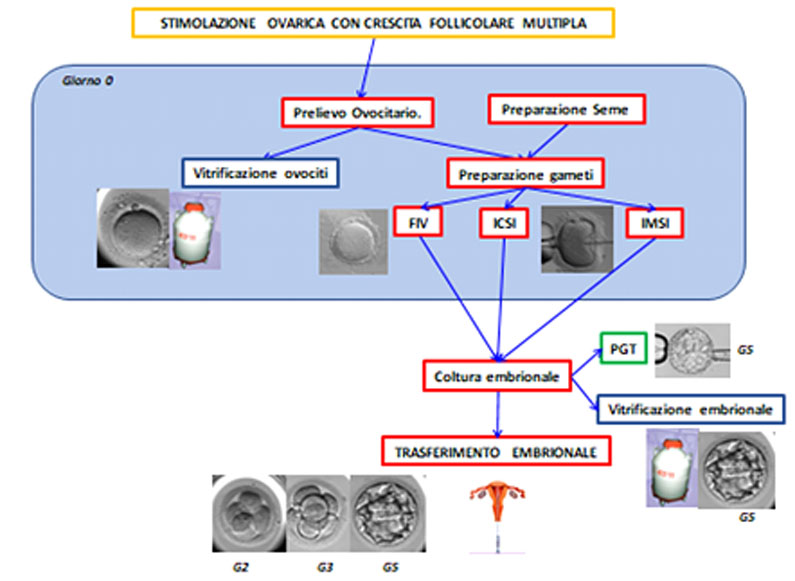
Figura 2: : fasi delle tecniche di fecondazione in vitro.
Viene programmato circa 34-36 ore dopo l’induzione dell’ovulazione con l’HCG, vale a dire poco prima di quello che sarebbe lo "scoppio" spontaneo dei follicoli. Gli ovociti vengono aspirati dai follicoli ovarici attraverso un ago per via trans-vaginale, fatto penetrare attraverso la parete vaginale, sotto controllo ecografico. Il prelievo ovocitario viene eseguito sotto anestesia locale o sedazione profonda e la paziente viene dimessa entro due ore dall’intervento.
La FIV letteralmente significa: "fecondazione in vitro e trasferimento embrionale". La FIV ha lo scopo di assicurare l'incontro degli spermatozoi con la cellula uovo e di poter osservare il processo di fecondazione e sviluppo dei primi stadi embrionari. Si ricorre alla FIV:
- in tutti i casi in cui ci sia un danno tubarico.
- in tutti i casi di moderata compromissione della quantità e/o della mobilità degli spermatozoi.
- in tutti quei casi in cui le tecniche di primo livello hanno fallito.
- dopo due anni di rapporti non protetti senza nessuna gravidanza e con diagnosi di sterilità idiopatica
- stimolazione ovarica della crescita follicolare multipla;
- prelievo ovocitario;
- preparazione dei gameti omologhi maschili e femminili
- inseminazione dell’ovocita con gli spermatozoi del partner;
- coltura embrionale in vitro,
- trasferimento in utero di embrioni e crioconservazione degli eventuali embrioni soprannumerari allo stato di blastocisti (quinta giornata) previo accordo con la coppia;
- supporto farmacologico della fase luteale.
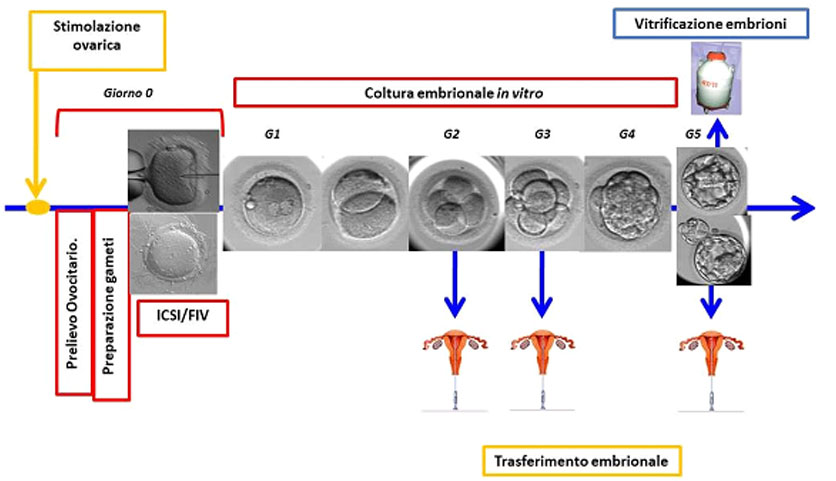
Figura 3: fasi dettagliate delle tecniche di fecondazione in vitro (FIV, ICSI, IMSI) con trasferimento in utero di embrioni freschi (seconda, terza o quinta giornata) e crioconservazione i di embrioni soprannumerari in quinta giornata.
ICSI significa letteralmente: iniezione intra - citoplasmatica di uno spermatozoo (Intra-cytoplasmic sperm injection). Questa tecnica può essere considerata una variante di laboratorio della FIVET poiché le fasi di stimolazione ovarica, l'uso di farmaci, la tempistica di stimolazione ed operatività sono pressoché identici alla FIVET. Questa tecnica, di introduzione più tardiva (1993) rispetto alla FIVET, ha rivoluzionato i limiti imposti alle metodiche di PMA in casi di fattore maschile grave o gravissimo. Oggi la ICSI permette di effettuare un intervento di PMA avendo a disposizione anche un numero di spermatozoi bassissimo: in pratica sono sufficienti tanti spermatozoi quanti sono gli ovociti recuperati.
Si ricorre alla ICSI:
- grave patologia seminale
- raccolta ovocitaria minima (recupero di un numero di ovociti inferiore a tre)
- in caso di mancata fertilizzazione con la FIVET.
- dopo due anni di rapporti non protetti senza nessuna gravidanza, con diagnosi di sterilità idiopatica e
sospetto di problemi al processo di fecondazione in vivo.
Fasi dell’ICSI:
- stimolazione ovarica della crescita follicolare multipla;
- prelievo ovocitario;
- preparazione dei gameti omologhi maschili e femminili;
- microiniezione di ogni ovocita con un singolo spermatozoo;
- coltura embrionale in vitro;
- trasferimento in utero di embrioni e crioconservazione degli eventuali embrioni soprannumerari allo stato di blastocisti (quinta giornata) previo accordo della coppia;
- supporto farmacologico della fase luteale.
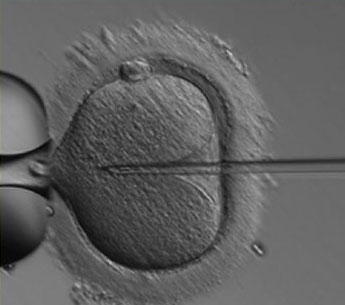
Figura 4: micro-iniezione di uno spermatozoo nell’ooplasma (ICSI).
IMSI significa letteralmente: iniezione intra-citoplasmatica di uno spermatozoo morfologicamente selezionato (Intracytoplasmatic Morfologically selected Sperm Injection). E' una variante della tecnica ICSI in cui lo spermatozoo da iniettare all'interno dell'ovocita viene selezionato morfologicamente, in tempo reale, mediante alti ingrandimenti microscopici (6600x). Per la selezione dello spermatozoo viene utilizzata un analisi non invasiva denominata MSOME (Motile Sperm Organellar Morphological Examination) che permette l'analisi dettagliata dei diversi organelli dello spermatozoo quali acrosoma, collo, coda, mitocondri e nucleo.
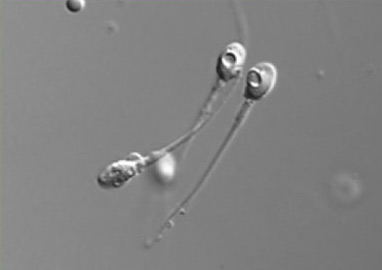
Figura 5: spermatozoi con presenza di vacuoli nella testa (x 6600) (IMSI).
Le indicazioni attuali per l'applicazione clinica della IMSI sono:
- grave forma di teratozoospermia (forme normali < 4% );
- ripetuti fallimenti di impianto;
- ripetuti aborti precoci;
- elevata percentuale di frammentazione del DNA degli spermatozoi;
- precedente ICSI senza fertilizzazione.
- stimolazione ovarica della crescita follicolare multipla;
- prelievo ovocitario;
- preparazione dei gameti omologhi maschili e femminili
- selezione su base morfologica degli spermatozoi a 6600x,
- microiniezione del singolo spermatozoo selezionato a 400x;
- coltura embrionale in vitro;
- trasferimento in utero di embrioni e crioconservazione degli eventuali embrioni soprannumerari allo stato di blastocisti (quinta giornata) previo accordo della coppia;
- supporto farmacologico della fase luteale
Il trasferimento embrionale è una procedura semplice che non richiede anestesia. Uno o più embrioni, sospesi in una goccia di terreno di coltura, vengono aspirati in un sottile catetere delicatamente inserito nell'utero e posizionati nel fondo della cavità uterina sotto assistenza ecografica trans-addominale con vescica piena. Ogni embrione può impiantarsi indipendentemente dagli altri.
Trasferendo più di un embrione si aumentano le probabilità di gravidanza ma aumentano anche i rischi di una gravidanza plurima.
La buona riuscita del ciclo riproduttivo assistito dipende dalla qualità biologica e dall’organizzazione cellulare degli embrioni (e dei gameti dai quali provengono) nonchè dalla capacità dell’utero di accoglierli con l’impianto.
Il trasferimento embrionale richiede 10-15 minuti. Dopo circa un’ora di riposo in posizione orizzontale la paziente può lasciare il Centro.
I tempi della coltura embrionale ed il giorno del trasferimento embrionale variano da 2 a 5 giorni a partire dal giorno del prelievo ovocitario. Gli embrioni trasferiti in seconda o terza giornata sono, normalmente, allo stadio chiamato ‘morula’. Gli embrioni trasferiti in quinta giornata sono allo stadio chiamato di “blastocisti”. L’equipe dei biologi del laboratorio di fecondazione in vitro decide il giorno del trasferimento in base ai seguenti criteri:
- regolarità dello sviluppo morfo-cinetico di ogni embrione;
- valutazione della presenza di eventuali anomalie morfo-cinetiche;
- numero di embrioni con sviluppo regolare e numero di embrioni con sviluppo irregolare;
- numero di embrioni che la coppia ha stabilito e sottoscritto, nel consenso informato insieme al medico, di trasferire in utero.
Dopo l’applicazione di una tecnica di fecondazione in vitro (FIVET, ICSI o IMSI), le cellule vengono immediatamente coltivate in vitro in specifici incubatori dotati di un sistema di monitoraggio cellulare continuo. Nei protocolli classici di coltura embrionale, le piastre contenenti le cellule sono estratte dall’incubatore ad intervalli prestabiliti al fine di controllare lo sviluppo embrionale al microscopio. Grazie all’utilizzo di incubatori multi-gas di nuova generazione, dotati da di un sistema ‘time-lapse’ composto da un microscopio, una telecamera integrata e un software per l’analisi dei dati, l’intero sviluppo di ogni embrione è osservabile ininterrottamente in modalità non-invasiva, cioè senza modificare e disturbare le condizioni di coltura in vitro. Questa modalità di coltura detta 'time-lapse monitoring' contribuisce ad ottimizzare lo sviluppo embrionale in laboratorio.
Durante la coltura in vitro, ogni embrione è permanentemente sotto osservazione e studiato in ogni suo particolare sviluppo morfologico in correlazione con i tempi di coltura. Vengono analizzati i parametri morfo-cinetici. Viene così determinato il giorno più adatto per eseguire il trasferimento embrionale e selezionato l’embrione o gli embrioni vitali da trasferire o crioconservare.
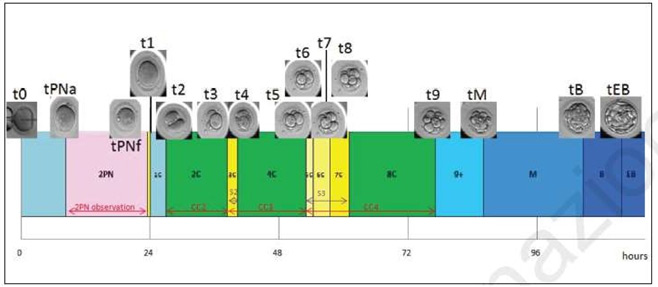
Figura 6: Morfo-cinetica embrionale fino allo stato di blastocisti (Chamayou e coll. 2013). Il valore ‘t’ definisce il tempo di divisione embrionale relativo allo stadio embrionale.
Alla luce della sentenza 151 del 2009 della Corte Costituzionale, è possibile mettere a fecondare un numero di ovociti che in ipotesi dovrebbero produrre il numero di embrioni da trasferire in utero (a discrezione del medico e della coppia). Talvolta accade che il numero di embrioni sviluppati superi il numero di embrioni da trasferire, ritenuto adatto per il raggiungimento della gravidanza. In quest’ultimo caso si pone l’esigenza di crioconservare gli embrioni competenti sviluppati in sovrannumero che non potranno essere trasferiti in utero per tutela della salute della donna. La crioconservazione degli embrioni soprannumerari, se da una parte costituisce un impegno categorico per la coppia al trasferimento degli embrioni crioconservati, dall’altra, nel caso di mancato ottenimento della gravidanza o nel tentativo di ottenere una ulteriore gravidanza, evita alla paziente il reiterare di stimolazioni ovariche, il rischio delle gravidanze plurime, e utilizza gli embrioni soprannumerari precedentemente crioconservati per un successivo trasferimento in utero.
Nel consenso informato per la tecnica di fecondazione in vitro, la coppia decide se accettare o rifiutare la possibile produzione di un numero di embrioni superiore a quello da trasferire e, di conseguenza, l’eventualità di crioconservazione di embrioni soprannumerari per un trasferimento in utero al più presto possibile. In alcune condizioni cliniche, non prevedibili al momento del prelievo ovocitario, si rende necessario non procedere con il trasferimento embrionale (esempio: sindrome d’iperstimolazione). Gli embrioni vengono crioconservati per essere trasferiti successivamente ed evitare di mettere a rischio la salute della donna. Nel laboratorio di Fecondazione in vitro, il protocollo di crioconservazione utilizzato per Il congelamento embrionale è la vitrificazione. Gli embrioni sono vitrificati allo stadio di blastocisti (embrione in quinta-sesta giornata). La percentuale di sopravvivenza embrionale dopo lo scongelamento è superiore a 98%.
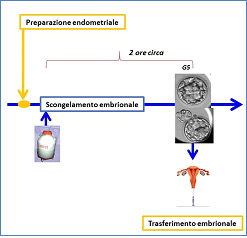
Figura 7: fasi dello scongelamento embrionale per trasferimento in utero.
I gameti maschili e femminili possono essere crioconservati al fine di posticipare il loro utilizzo riproduttivo, preservando così, la fertilità del paziente o della paziente. Gli spermatozoi possono essere crioconservati da un campione di seme prodotto con la masturbazione o dopo prelievo chirurgico (PESA, MESA). È possibile crioconservare i propri gameti per creare una ‘riserva’ utilizzabile il giorno della tecnica di fecondazione in vitro o prima di un trattamento medico o chirurgico sterilizzante come, ad esempio, un trattamento oncologico.

Figura 8: Paillettes contenenti materiale biologico riproduttivo, in crioconservazione.
Gli ovociti maturi possono essere crioconservati con il metodo biologico di ‘vitrificazione’.
Gli ovociti sono recuperati dopo stimolazione ovarica e prelievo ovocitario.
Gli ovociti maturi sono crioconservati lo stesso giorno. La percentuale di sopravvivenza ovocitaria dopo lo scongelamento è superiore a 70%; la sopravvivenza dipende dell’età della paziente.
Gli ovociti possono essere crioconservati:
- per accumulare una riserva ovocitaria (esempio: pazienti candidati a Test Genetico Preimpianto);
- quando la coppia rifiuta l’eventuale possibilita’ di produrre embrioni in sovrannumero in un trattamento di fecondazione in vitro;
- nel caso in cui la fecondazione in vitro non sia possibile per mancanza dei gameti maschili;
- in donne che desiderano posticipare il loro progetto genitoriale (es. social freezing).
Dopo lo scongelamento, gli ovociti devono essere micro-iniettati con la tecnica ICSI per essere fertilizzati.
La crioconservazione e lo scongelamento dei gameti implica il consenso scritto del/la paziente il giorno dell’utilizzo nel percorso di riproduzione medicalmente assistita.
Lo scopo dei tests genetici in fase preimpianto è quello di ottenere una gravidanza a partire da un embrione formato in vitro privo di una specifica malattia genetica o di anomalie cromosomiche. L’analisi genetica viene eseguita su richiesta della coppia al fine di conoscere lo stato di salute dell’embrione, comma 5 dell’Art. 14 della Legge 40/2004.
La procedura medico-biologica applicata è un test genetico (in fase) preimpianto (PGT: Preimplantation Genetic Test). La PGT non sostituisce la diagnosi prenatale, ma ha l’obiettivo di anticipare la diagnosi prenatale al fine di evitare l’aborto terapeutico di un feto affetto.
Le applicazioni dei Tests Genetici in fase Preimpianto sono:
- test genetico preimpianto per malattie genetiche (PGT-M) rivolto alle coppie fertili e infertili ad alto rischio di trasmettere una malattia genetica specifica al nascituro (Esempi: beta-talassemia, fibrosi cistica, distrofia muscolare, neurofibromatosi, ecc.);
- test genetico preimpianto per anomalie strutturali dei cromosomi (PGT-SR) rivolto alle coppie infertili in cui un membro
è portatore di un’anomalia cromosomica strutturale. Queste coppie sono spesso soggette a infertilità, a rischio di aborti ricorrenti o ad avere un bambino con gravi disabilità intellettive e/o motorie (esempi: traslocazioni robertsoniane e reciproche;
- test genetico preimpianto per anomalie numeriche dei cromosomi (PGT-A) rivolto alle coppie in cui entrambi i membri hanno un cariotipo normale e che presentano, a priori, un rischio elevato di produrre embrioni aneuploidi dovuto alle loro condizioni cliniche.
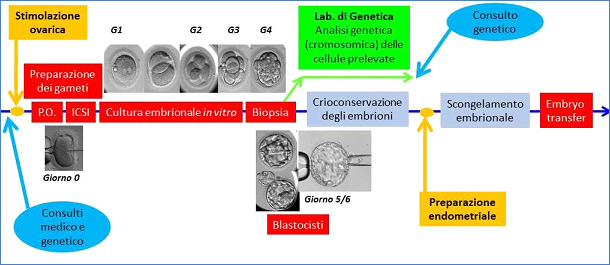
Figura 10: fasi del protocollo di test genetico preimpianto.
Le procedure di PGT e la loro efficacia sono spiegate e approfondite nelle specifiche brochure in allegato alla presente carta dei servizi e sul sito www.hera.it. (vedere ALLEGATI-CdS-05, 06, 07 e 08)
Note bene: negli anni passati, il PGT veniva chiamato diagnosi genetica preimpianto.
Nel caso di cui è stato accertato la sterilità (mancanza di gameti maschile o femminili) all'interno della coppia, sulla base della sentenza n.162/2014 della Corte Costituzionale, è possibile ricorrere ad un tecnica di procreazione medicalmente assistita con un gamete (ovocita o spermatozoi) esterno alla coppia. In casi di donazione degli spermatozoi, a seconda dei risultati degli esami diagnostici femminili, si potrà ricorrere all'IUI o all'ICSI con seme di donatore. In caso di donazione degli ovociti congelati, si ricorrerà alla tecnica ICSI.
La paziente può condurre una vita normale cercando di evitare sforzi eccessivi ed attività sportive impegnative.
La sera precedente il trasferimento embrionale, si inizia la somministrazione di progesterone (o per via intra-muscolo o per via intra-vaginale). Altri farmaci verranno somministrati a seconda del protocollo adottato o sulla base delle esigenze particolari della paziente.
La terapia progestinica dovrà essere continuata per almeno 14 giorni, fino al test ematico di gravidanza (dosaggio del βHCG, un ormone prodotto dall’embrione).
Se il test:
Nel caso di positività del test di gravidanza, la paziente dovrà continuare la terapia intrapresa in accordo con i medici del Centro almeno fino al primo controllo ecografico che avverrà all'incirca dopo due settimane (corrispondente a sei settimane di gravidanza).
La gravidanza sarà seguita e monitorizzata dai medici del Centro fino al compimento della 12° settimana di amenorrea.
Da quella data in poi, la paziente verrà affidata al proprio ginecologo di fiducia per seguire la gravidanza, con eventuali consigli da prendere in considerazione per il rimanente corso della gravidanza.
Il Centro avra’ cura e si impegna a contattatare telefonicamente la paziente con un proprio operatore dopo la data presunta
del parto, per avere informazioni sull’andamento della gravidanza dopo la 12º settimana, sulle modalità del parto e sullo stato di
salute della madre e del nascituro.
Oltre alle procedure di riproduzione medicalmente assistita e fecondazione in vitro, dettagliate nella presente brochure, il Centro HERA - U.M.R. svolge le seguenti prestazioni a supporto della fase diagnostica, del percorso terapeutico e della gravidanza:
- consulenza specialistica (ginecologica, andrologica, ostetrica, genetica, psicologica, nutrizionale)
- servizio di ecografia per la donna: bi e tridimensionale per lo studio del feto e dell’apparato ginecologico, ecografia mammaria, tiroidea, flussimetria, isterosonosalpingografia, traslucenza nucale
- servizio di ecografia per l’uomo: ecografia testicolare, tiroidea, doppler,
- attività di sala operatoria (prelievo chirurgico dei gameti maschili e femminili, isteroscopia diagnostica e operativa, biopsia endometriale);
- analisi biologiche su prelievi di sangue (dosaggi ormonali, cariotipi, screening genetici per AZF e fibrosi cistica di 3° livello, set-up molecolare per test genetico preimpianto delle malattie genetiche - PGT),
- analisi biologiche su campioni di seme (spermiogramma, prova diagnostica, test di frammentazione del DNA spermatico, autoconservazione);
- analisi genetiche su cellule embrionali (test genetico preimpianto - PGT) e fetali (diagnosi prenatale);
- analisi biologiche su campioni ginecologici (tamponi vaginali, pap-test, microbiota).
Tecniche, test genetici, le emozioni
In breve IUI. È una tecnica semplice con un indice di successo notevole
Ha lo scopo di assicurare l'incontro degli spermatozoi con la cellula uovo
La donazione di gameti offre il maggior tasso di gravidanza, fino a un 94%
Analisi genetica dell'embrione prima del suo trasferimento
© Copyright 2018 Centro HERA - U.M.R.
